Theo thầy Phan Trọng Quý (Trường trung học Thực hành - ĐH Sư phạm TP.HCM), khi ôn tập môn Hóa cho kì thi THPT Quốc gia 2019, thí sinh nên hãy tự đặt câu hỏi rồi trả lời bằng các ý lớn. Tiếp đến, cụ thể hóa bởi điều kiện phản ứng và dùng sách giáo khoa (SGK) xét phản ứng của chất cụ thể. Nhờ đó, việc ôn tập môn này sẽ trở nên dễ dàng hơn.
> Thi thử THPT quốc gia 2019: Đề thi thử và đáp án môn Toán ở Đà Nẵng
> Bí quyết ôn thi môn Lý hiệu quả trong kỳ thi THPT 2019
Có thể dùng sơ đồ để tổng kết
Ví dụ 1: để ôn lại mối liên hệ giữa hidrocacbon và một số dẫn xuất của hidrocacbon ta nêu câu hỏi: Các phương pháp chuyển hidrocacbon no thành không no hoặc thơm? - Phương pháp dehidro hóa và crackinh; ngược lại, để chuyển hidrocacbon không no hoặc thơm thành no? - Sử dụng phương pháp hidro hóa hoàn toàn và không hoàn toàn.
Ví dụ 2: để chuyển hidrocacbon trực tiếp thành dẫn xuất chứa oxi có thể dùng cách nào? - Oxi hóa hidrocacbon và hidrat hóa anken (thành ancol), hay hidrat hóa ankin (thành andehit, xeton). Sau đó tiếp tục triển khai cụ thể hơn chút nữa về chất phản ứng và điều kiện: KMnO4 loãng lạnh oxi hóa anken sẽ tạo điol, nhưng nếu KMnO4 đặc nóng thì lại bẻ gãy mạch cacbon tạo hợp chất cacbonyl.

Thí sinh nên dùng sơ đồ để ôn tập lý thuyết.
Cần hiểu đúng bản chất hóa học và các "thuật ngữ khoa học"
Một số thuật ngữ được nêu dưới đây rất thường gặp, nhưng lại bị hiểu sai do không nắm vững kiến thức. Cần chính xác hóa để tránh mất điểm trong bài thi!
a) Không phân biệt được bản chất của "dầu mỡ để ăn" (thực phẩm) hay "dầu thực vật" với "dầu mỡ làm nhiên liệu, bôi trơn: Dầu mỡ ăn được là chất béo, thành phần chính là trieste của glyxerol và các axit béo; còn dầu mỡ bôi trơn có thành phần chính là hidrocacbon.
b) Không hiểu rõ về "quy ước tính tan" của muối và bazơ, nên trả lời sai về chất điện li, sai khi viết phương trình ion thu gọn:
- Không có chất nào tuyệt đối không tan mà đều ít hay nhiều tan trong nước, vì thế các muối AgCl, BaSO4, CaCO3… là chất điện li mạnh.
- Ion hidrosunfat HSO4- mặc dù gây ra môi trường axit mạnh, nhưng phân li không hoàn toàn, nên khi viết phương trình ion không được viết tách thành H+ và SO42-. Thí dụ phương trình ion thu gọn giữa KHSO4 và KHCO3 phải viết đúng là: HSO4- + HCO3- → CO2↑ + H2O + SO42- mà không được viết H+ + HCO3- → CO2↑ + H2O
c) Không hiểu rõ thuật ngữ khoa học dẫn tới việc phân biệt, nhận biết các chất hoặc mô tả hiện tượng sai khi xét các phản ứng hóa học. Chẳng hạn:
- Thuật ngữ "dung dịch brom" thì phải hiểu là dung môi nào cũng được, nhưng "nước brom" thì dung môi phải là H2O. Để phân biệt CH4 với C2H4 có thể dung dịch brom là Br2/CCl4 hay Br2/H2O vì dung môi không tham gia vào phản ứng, nhưng để phân biệt CO2 với SO2 hoặc nhận biết andehit thì phải dùng "nước brom", vì H2O tham gia vào phản ứng.
SO2 + Br2 + 2H2O →H2SO4 + 2HBr
R-CHO + Br2 + H2O → R-COOH + HBr
Để nhận biết phenol cũng phải dùng "nước brom" vì nước là dung môi phân cực, có tác dụng ion hóa phân tử Br2: Br2 → Br+ + Br-.
- Thuật ngữ "chất giặt rửa" để chỉ chất có tác dụng làm sạch các chất bẩn bám mà không gây phản ứng hóa học với các chất đó, còn "chất tẩy rửa" hay "chất tẩy màu" thì lại làm sạch các vết màu bẩn nhờ những phản ứng hóa học.
Màu sắc của các chất và sự pha trộn màu sắc của các hóa chất thường gặp
Thuật ngữ về màu sắc và sự lẫn lộn giữa chúng cũng làm cho các em mất điểm oan. Các màu sắc được ghi dưới đây giúp các em tránh được sai lầm đó:
- Không nhầm lẫn "không màu" với "màu trắng" của các gluxit; hay màu "xanh tím" của phèn crom-kali KCr(SO4)2.12H2O và của sản phẩm phản ứng giữa hồ tinh bột và I2 phải khác với màu "tím" đặc trưng là màu của sản phẩm phức tạp giữa protein và ion Cu2+ (phản ứng màu biure của protein với Cu(OH)2); trong khi màu "tím hồng" là của ion MnO4- (dung dịch thuốc tím KMnO4).
- Các hợp chất cacbohidrat không màu: gồm các loại đường glucozơ, fructozơ, saccarozơ, mantozơ.
- Màu trắng: AgCl ; BaSO4 ; CaCO3; CaSO4; Zn(OH)2; Al(OH)3; CaO; Ca(OH)2↓; MgO; Mg(OH)2.
- Màu "xanh thẫm" của ion phức [Cu(NH3)4]2+ (còn gọi là "xanh lam đậm" hay "xanh lam đặc trưng") khác với "màu xanh" (còn gọi là "xanh lam" của ion Cu2+ khi bị hidrat hóa (phân biệt rõ CuSO4 dạng khan có màu trắng, còn tinh thể ngậm nước CuSO4.5H2O có màu xanh) hay "màu xanh" của Cu(OH)2.
- Màu "xanh lục" của kết tủa Ni(OH)2 phải được hiểu là đậm hơn màu "xanh lá cây" của các muối niken (Ni2+) hay "màu xanh" của ion phức [Ni(NH3)6]2+.
- Màu "trắng hơi xanh" của Fe(OH)2 và chì kim loại (Pb); màu "lục nhạt" của FeCl2 (Fe2+).
- Màu "đen" thường gặp: CuS, PbS, Ag2S, CuO.
- Màu "vàng" gồm CrO42-, Cr(OH)2, S và sự khác nhau về cấp độ màu: "da cam" còn gọi là "vàng cam" của Cr2O72-, "vàng lục" của khí Cl2; "vàng tươi" của BaCrO4; "vàng nhạt" của AgBr ; "vàng đậm" của AgI.
- Màu đỏ HgI2, với các cấp độ: "đỏ thẫm" CrO3, "nâu đỏ" của Fe(OH)3, "đỏ máu" của Fe(SCN)3.
- Màu của kim loại: "màu trắng" kim loại Ag, "trắng bạc" gồm Ni, Sn; "lam nhạt" là Zn, Au "màu vàng", còn Cu "màu đỏ".
- Màu "lục xám" Cr(OH)3 (theo SGK nâng cao thì có "màu xanh").
Một số phản ứng không theo quy luật chung của nhóm hoặc phản ứng có ứng dụng đặc biệt
Có hàng loạt các phản ứng (trong SGK) của các chất không tuân theo quy luật chung. Truy tầm và ghi nhớ chúng giúp các em tránh được bẫy cài trong câu hỏi thực tiễn hoặc đúng - sai.
Tính oxi hóa của NO3- trong môi trường kiềm mạnh tạo NH3:
8Al + 5OH - + 3NO3- + 2H2O → 8AlO2- + 3NH3↑
Ảnh hưởng của nhiệt độ tới tốc độ phản ứng (hoặc nêu hiện tượng quan sát được, sản phẩm tạo thành):
Na2S2O3 + H2SO4 (Loãng) →Na2SO4 + SO2↑ + S↓ + H2O
Phản ứng của Flo khác với các halogen, và sự xuất hiện số oxi hóa (+2) của oxi:
2F2 + 2H2O → 4HF + O2↑
2F2 + 2NaOH (Loãng, lạnh) → 2NaF + H2O + OF2
Một vài phản ứng của hợp chất silic:
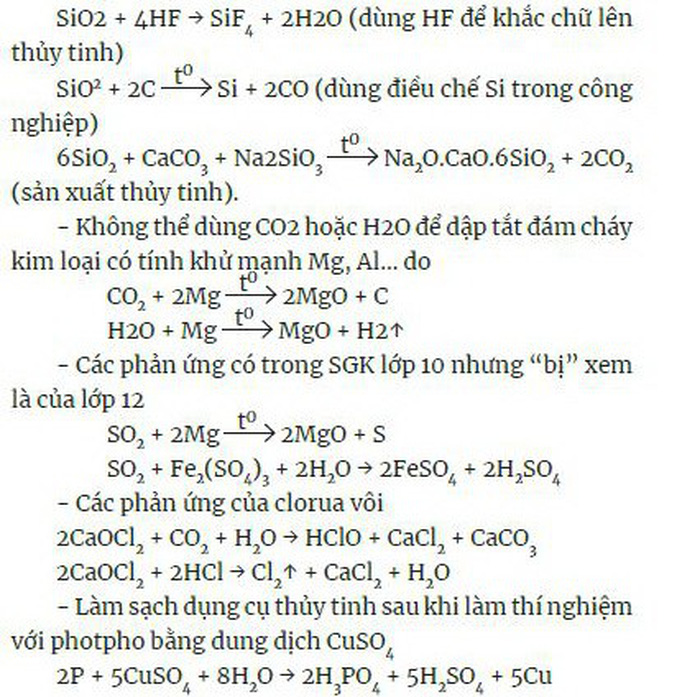
Cuối cùng, để ghi nhớ lại tất cả thông tin, các thí sinh nên làm hết các câu lý thuyết trong SGK và sách bài tập đi kèm của cả 3 lớp 10, 11 và 12.
Theo Thanh niên




